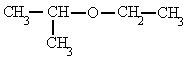Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al.
- Se comportan como reductor, por oxidación el aldehído de ácidos con igual número de átomos de carbono.
- La reacción típica de los aldehídos y las cetonas es la adición nucleofílica
Nomenclatura:
Se nombran sustituyendo la terminación -ol del nombre del hidrocarburo por -al. Los aldehídos más simples (metanal y etanal) tienen otros nombres que no siguen el estándar de la Unión Internacional de Química Pura y Aplicada (IUPAC) pero son más utilizados (formaldehído y acetaldehído, respectivamente) estos últimos dos son nombres triviales aceptados por la IUPAC. La f+ormula aplicada para los siguientes aldehidos es: H-(CH2)n-CHO
Algunos ejemplos son:
| Metanal | Formaldehídos | HCHO |
| Propanal | Propionaldehído Propilaldehído |
C2H5CHO |
| Hexanal | Capronaldehído n-Hexaldehído |
C5H11CHO |
| Decanal | Caprinaldehído n-Decilaldehído |
C9H19CHO |